На сегодняшний день маркировка лекарственных средств и фармацевтических товаров является обязательной мерой. Поэтому компании и индивидуальные предприниматели, которые занимаются продажей медикаментов, где нет чипов, подвергаются штрафным санкциям. Также штрафы начисляются, если выявляются нарушения, когда данные передаются в систему мониторинга. Какие основные требования к маркировке лекарственных препаратов в РФ, чтобы избежать штрафных санкций?
31 декабря 2019 года заканчивается эксперимент по маркировке лекарственных препаратов, и уже с 1 января 2020 года работа в ГИС Маркировка станет обязательным. Предлагаем вашему вниманию подробную инструкцию для аптек и медицинских учреждений для работы по новым правилам.
Главная цель внедрения маркировки – это противодействие производству и обороту недоброкачественной, а также контрафактной и фальсифицированной продукции. Покупатель, отсканировав QR-код, сможет увидеть:
1.общие сведения о лекарстве: наименование производителя, адрес фирмы, информацию о составе, сроке службы, условиях хранения и многое другое.
2. проверить легальность продукции.
Журнал «Аптека: бухгалтерский учет и налогообложение» № 2/2017
С 01.02.2017 начался эксперимент по маркировке лекарственных средств. Как это затронет работу аптек?
30 января 2017 года было опубликовано Постановление Правительства РФ от 24.01.2017 № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» (далее – Постановление № 62). О том, как проведение данного эксперимента затронет работу аптек, читайте в предложенном материале.
На территории Российской Федерации 1 февраля 2017 года начался эксперимент по маркировке лекарственных средств. Таким образом, борьба с контрафактными и фальсифицированными лекарствами вышла на новый качественный уровень.
- На чем основана маркировка лекарств
- Что такое маркировка лекарств и как выглядит код
- Что такое код маркировки лекарственных препаратов? Для чего предназначается?
- Основные задачи маркировки и мониторинга перемещения медикаментов
- Цели внедрения маркировки лекарств.
- Правовые основания для проведения эксперимента.
- Как начать работать в ГИС Маркировка?
- Основные положения проведения эксперимента.
- Маркировка лекарственных средств
- Маркировка лекарственных препаратов
- Принципы функционирования системы мониторинга фармпрепаратов
- Прием товара в аптеке и маркировка
- Розничная продажа лекарств в аптеках
- Как производителю работать с маркировкой
- Как отсканировать код
- Текущие недоработки системы
- Штрафы за отсутствие маркировки
- Особенности регистрации
- Маркировка лекарственных средств и сроки ее проведения
- Штраф или лишение свободы?
- Задачи системы мониторинга перемещения лекарственных препаратов
- Подробно о маркировке лекарств
- Штрафные санкции
- Какие организации являются пользователями системы маркировки лекарств?
- Какие лекарства подлежат маркировке?
- Сроки перемен
На чем основана маркировка лекарств
Маркировка лекарств основана на информационной системе мониторинга движения лекарственных препаратов (ИМ МДЛП). В базе программного продукта хранится информация о производителях и импортерах, оптовых и розничных продавцах фармацевтических товаров, об операциях, которые связаны с ними. В перечень последних входит:
Система ИС МДЛП подключена к программному комплексу «Честный ЗНАК», задача которого – защита потребителей от подделок. Механизм простой. Если нет маркировочного штрих-кода или он нанесен с ошибками, товар не удастся внести в базу ИС МДЛП. Это спасает покупателей от вреда здоровью, наносимого некачественными лекарствами.
Что такое маркировка лекарств и как выглядит код
Маркировка лекарств предполагает распечатку на упаковке штрих-кода типа Data Matrix. Он нужен для идентификации препаратов, отслеживания перемещений с момент производства до их покупки конечным потребителем. Система запрещает реализацию лекарств без специального кода, т.к. при работе с товаром требуется его сканирование. На основе маркера программа формирует реквизит соответствующей номенклатуры, который печатается на кассовом чеке.
Идентификатор Data Matrix включает информацию:
Что такое код маркировки лекарственных препаратов? Для чего предназначается?
Data Matrix является уникальным двумерным штрих-кодом, который состоит из цифр и букв. В его составе код идентификации и код проверки.
Код идентификации состоит из двух частей. Первой является международный код товара GTIN. В нем 14 знаков. Второй частью является индивидуальный серийный номер из 13 символов. При этом на медикаментозные препараты наносится не только штрих-код, но и фрагмент текста. Данное требование распространяется только на медикаменты, для других видов продукции оно не действует.
Кодом идентификации называется электронная подпись, состоящая из четырех символов ключа и 44 символов значения кода. Данная подпись позволяет осуществить проверку лекарственного средства на предмет его законности.
Обязательная маркировка лекарств находится на их упаковке. Как правило, это может быть коробка из картона, а при ее отсутствии, блистер, ампула и др. Также код может печататься на этикетке, если она не отделяется от упаковки без повреждений.
Маркироваться должна и транспортная упаковка с продукцией фармакологической отрасли. Здесь ставится групповой штрих-код, а не Data Matrix. Допускается, чтобы он был линейный, а не двумерный.
Основные задачи маркировки и мониторинга перемещения медикаментов
Используя маркировку и отслеживая движение лекарственных препаратов, государство:
Преимущества для граждан страны заключаются в том, что в любой момент можно проверить, является ли легальным конкретный препарат. Для этого потребуется только смартфон и доступ в интернет.
Компании и индивидуальные предприниматели получают возможность управлять логистикой более эффективно, снизить упущенную выгоду из-за контрафактной продукции и фальсификата, соответствовать требованиям в отношении поставок фармакологической продукции на международные рынки сбыта.
Цели внедрения маркировки лекарств.
О том, что сегодня на рынке встречаются контрафактные и фальсифицированные лекарства, известно всем – как потребителям, так и контролирующим органам.
Главной целью внедрения маркировки лекарственных препаратов контрольными (идентификационными) знаками является противодействие незаконному производству лекарственных препаратов на территории РФ и их ввозу на данную территорию, что должно полностью уничтожить незаконный оборот лекарств. Еще одной важной задачей, которую призвана решить маркировка лекарств, являются стандартизация и унификация процедур учета поставок и распределения лекарственных препаратов, в том числе закупаемых для государственных нужд.
Ключевая цель проекта – защита населения от фальсифицированных, недоброкачественных и контрафактных лекарственных препаратов.
Поскольку проект является масштабным мероприятием, принято решение в 2017 году провести эксперимент (пилотный проект) по маркировке лекарственных препаратов, с учетом результатов которого проект будет развиваться дальше. Цели эксперимента вполне конкретные, а именно определение:
– эффективности и результативности разрабатываемой системы контроля за движением на территории РФ лекарственных препаратов от производителя (импортера) до конечного потребителя в целом и каждого из участников рынка лекарственных препаратов в отдельности;
– изменений, которые необходимо внести в нормативные правовые акты РФ, регламентирующие сферу обращения лекарственных препаратов, в случае принятия решения о внедрении мониторинга за оборотом отдельных видов лекарственных препаратов;
– технических возможностей информационной системы, в которой будет осуществляться информационное обеспечение проведения эксперимента, и необходимости ее дальнейшего развития.
С учетом результатов эксперимента будут приниматься дальнейшие решения по внедрению на территории РФ системы мониторинга движения лекарственных препаратов.
Правовые основания для проведения эксперимента.
Еще в 2015 году Минздраву было поручено обеспечить разработку и поэтапное внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки (кодификации) и идентификации упаковок лекарственных препаратов (по итогам совещания с членами Правительства РФ 04.02.2015 (п. 5 Поручения Президента РФ № Пр-285 от 20.02.2015)). Данная система мониторинга должна обеспечить эффективный контроль качества лекарственных препаратов, находящихся в обращении.
При маркировке 100 % выпускаемых лекарственных препаратов система мониторинга будет отслеживать около 6 млрд упаковок лекарственных препаратов в год и охватит более 350 тыс. участников оборота, среди которых около 1 тыс. отечественных и зарубежных производителей лекарственных средств, свыше 100 тыс. медицинских и 250 тыс. аптечных организаций.
Был разработан и утвержден приоритетный проект «Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя для защиты населения от фальсифицированных лекарственных препаратов и оперативного выведения из оборота контрафактных и недоброкачественных препаратов» (Протокол от 25.10.2016 № 9). Данный проект действует с 25 октября 2016 года по 1 марта 2019 года и состоит из двух этапов:
Автоматизированная система мониторинга движения лекарственных препаратов – ФГИС МДЛП – предполагает регистрацию всех участников: производитель, организация оптовой торговли, в том числе осуществляющая импорт лекарств, аптечная организация, медицинская организация, реализация потребителю. С помощью данной системы планируется мониторинг движения лекарственного препарата на всех этапах его обращения в разрезе конкретного лекарства, конкретной серии и упаковки.
В рамках реализации данного приоритетного проекта будет проведен эксперимент по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарств на основании Постановления № 62, которым
утверждены:
Как начать работать в ГИС Маркировка?
Предлагаем Вам пошаговую инструкцию по внедрению системы маркировки лекарственных средств:
1. Проверьте наличие и срок лицензии на фармацевтическую или медицинскую деятельность. Для этого удобно использовать сервис сайта Росздравнадзора: http://www.roszdravnadzor.ru/services/licenses.
2. Получите усиленную квалифицированную электронную подпись (УКЭП) руководителя организации в аккредитованном Минкомсвязи удостоверяющем центре (УЦ). Список таких центров можно загрузить с сайта Минкомсвязи по ссылке https://digital.gov.ru/ru/activity/govservices/2/.
a. Обеспечьте УКЭП сотрудников (для работы).
b. Установите средство криптографической защиты информации (СКЗИ), содержащее криптопровайдер (CSP) с поддержкой ГОСТ Р 34.10-2012 (список сертифицированных на соответствие указанному ГОСТ СКЗИ доступен на сайте ФСБ РФ по ссылке http://clsz.fsb.ru/certification.htm, консультацию по выбору можно получить в УЦ при получении УКЭП)
3. Убедитесь в полном соответствии ФИО руководителя и ИНН организации, указанные в УКЭП, сведениям, внесенным в ЕГРЮЛ/ЕГРИП. Для проверки можно применить сервис ФНС на сайте https://egrul.nalog.ru/index.html.
В личном кабинете ИС «Маркировка», в профиле, в подразделе «Места деятельности» обязательно добавьте адреса ваших зданий! Также проверьте, что адреса вашей организации зарегистрированы в системе ФИАС (http://fias.nalog.ru).
5. Доработайте учетную информационную систему аптеки медицинской организации для работы с ИС МДЛП. При необходимости, закажите доработку используемых у Вас информационных систем для автоматизации разработанных бизнес-процессов как описано в документе «Паспорта процессов», размещенном в разделе «Маркировка лекарств» на сайте https://ЧестныйЗНАК. РФ в подразделе «Документы», блок «Основные действия участников МДЛП».
Обратите внимание на то, что Вам необходимо зарегистрировать в ИС МДЛП используемую в Вашей организации информационную систему, с помощью которой предполагается выполнять обмен данными с ИС МДЛП.
6. Что касается программного обеспечения, то обратите внимание на то, что Центр развития перспективных технологий (ЦРПТ) и фирма «1С» провели совместное тестирование обновленных версий программных продуктов «1С:Розница. Аптека», «1С:Управление аптечной сетью» и продуктов линейки «1С:Медицина» с поддержкой информационной системы мониторинга движения лекарственных препаратов (ИС МДЛП).
8. Необходимо оборудовать рабочее место сотрудника аптеки: компьютер, сканер двумерных штрих-кодов (DataMatrix) или терминал сбора данных (АТОЛ SMART. DROID 2D), УКЭП. При выборе сканера для считывания маркировки подойдут «2D-типы» сканеров штрих-кодов, например, Motorola DS4308-HD, в характеристиках которых указано, что он способен сканировать штрих-код «DataMatrix». Для удобства использования, рекомендуется приобретать беспроводные сканеры с USB-интерфейсом. Компьютер должен иметь операционную систему Windows 7 или новее / Mas OS X 10.8 или новее.
9. Ответы на часто задаваемые вопросы по системе «Маркировка» можно получить на сайте: http://www.roszdravnadzor.ru/marking/answers.
Игорь Усманов
специалист компании «Аудэкс»
Департамент автоматизации учета
Основные положения проведения эксперимента.
Постановлением № 62 установлены основные правила проведения пилотного проекта по маркировке лекарств (см. таблицу). Конкретные разъяснения по применению документа дал Росздравнадзор.
Для проведения данного пилотного проекта требуется значительное количество нормативных актов, которые планируется выпустить в виде методических рекомендаций, в том числе:
Планируется, что до июня 2017 года будет доработано программное обеспечение, произведена его установка на промышленном контуре и предоставлен доступ к системе участникам эксперимента. Непосредственными исполнителями работ являются Росздравнадзор и ФНС – в части информационной системы.
По данным Росздравнадзора готовность принять участие в пилотном проекте выразили 23 производителя лекарственных средств, 4 крупнейших фармацевтических дистрибьютора, свыше 30 медицинских организаций и более 250 организаций розничной торговли лекарственными препаратами, в том числе аптечные сети федерального и регионального масштаба.
Таким образом, аптеки будут непосредственными участниками данного эксперимента.
Поскольку основная цель маркировки упаковок лекарственных препаратов двухмерным штриховым кодом – дать возможность каждому покупателю лекарственного препарата проверить его легальность с помощью смартфона или общедоступного сканера в аптеке, аптеки должны будут быть оснащены специальным оборудованием – сканерами или считывающими устройствами.
Кто и за чей счет будет устанавливать данное оборудование? Предполагается, что муниципальные аптеки будут оснащаться за счет средств муниципалитета, а частные аптеки с момента введения обязательного порядка применения соответствующих сканеров должны будут приобрести указанное оборудование сами и за свой счет. Таким образом, у аптек появится новая обязанность не просто установить сканеры, а еще и поддерживать их в рабочем состоянии. При этом, возможно, названные устройства потребуют опломбировки, чтобы исключить несанкционированный доступ. Пока требования к ним не установлены.
1 февраля 2017 года на территории РФ начался эксперимент по маркировке лекарственных средств. На данном этапе эксперимент проводится в шести регионах РФ, и участие в нем является добровольным. В ходе эксперимента будут проведены предварительная апробация и оценка эффективности основных организационных и технологических решений создаваемой системы мониторинга движения лекарственных препаратов, определены оптимальные технологические требования и решения, а также необходимые изменения и дополнения в нормативные правовые акты РФ, регламентирующие сферу обращения лекарственных препаратов.
Планируется, что уже с 1 января по 31 декабря 2018 года будет поэтапно введена обязательная маркировка всех 100 % лекарственных препаратов, что позволить исключить из оборота фальсифицированные и контрафактные лекарства.
Аптеки должны будут оснастить свои торговые залы специальными считывающими устройствами – сканерами, которые позволят покупателям проверить штрих-код лекарственного препарата.
Маркировка лекарственных средств
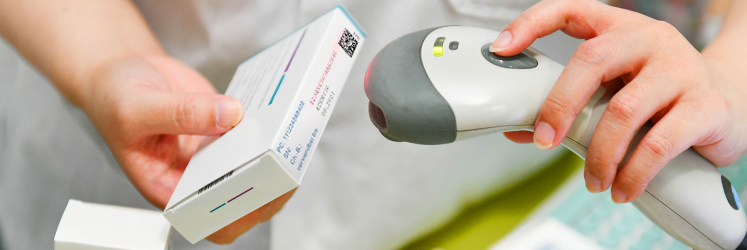
В июле 2020 года стартовал последний этап обязательной маркировки лекарственных препаратов и фармацевтических товаров. Однако в отдельных случаях можно получить отсрочку. Для этого необходимо обратиться в Росздравнадзор за специальным согласованием, которое дает право отгружать, принимать и продавать медикаменты без штрих-кода Data Matrix. Что еще нужно знать о маркировке лекарств? Вся необходимая информация — в нашей статье.
Маркировка лекарственных препаратов
Маркировка — это нанесение на сам фармацевтический продукт, его упаковку (вторичную — в которой размещен он сам, или транспортную — в которое располагается несколько вторичных упаковок) марки — идентификатора, подтверждающего подлинность товара.
Марку «привязывает» к товару или к его упаковке производитель (импортер) лекарственных средств. Далее он передает товар оптовикам, а те — в розничные точки. Каждый из участников оборота товара — производитель (импортер), оптовик и розничный продавец, в установленном порядке фиксируют совершение тех или иных операций с товаром, на который нанесена марка.
Как правило, это две основные операции — приемка и последующий отпуск потребителю (розничному продавцу — от оптовика, физическому лицу — от розничного продавца). Все они складываются в логистическую цепочку: в целостном виде она точно удостоверяет, что промаркированный товар прошел полный путь от производителя до розничного прилавка. А значит — то, что товар подлинный.
Несколько шагов и Модулькасса ваша
Для малого и среднего бизнеса
Шаг 1 из 2
Выберите состав комплекта
11 900 ₽
Модулькасса с встроенным эквайрингом
24 900 ₽
Шаг 2 из 2
Оставьте, пожалуйста, свои контакты
«Вклиниться» в эту цепочку несанкционированному участнику сложно, поскольку регистрация всех операций участниками данной цепочки осуществляется с использованием квалифицированных электронных подписей (КЭП). То есть, чтобы «вклиниться», надо эту подпись подделать или получить в распоряжение. Оба действия легко обнаруживаются участниками оборота — и по факту такого обнаружения поставка блокируется, поскольку никто не заинтересован в том, чтобы в оборот попадал контрафакт.
Таким образом, маркировка сводит к минимуму появление на прилавках поддельных товаров.
Особенно это важно в фарминдустрии. Поэтому, внедрению системы маркировки лекарственных средств государство уделило повышенное внимание и учредило целую систему мониторинга движения лекарственных препаратов — МДЛП.
Участие в обороте маркированных фармацевтических товаров осуществляют, таким образом, его производители, оптовики и те хозяйствующие субъекты, которые обеспечивают реализацию или практическое использование лекарственных средств:
Участие каждого из указанных категорий хозяйствующих субъектов в обороте маркируемой фармацевтической продукции осуществляется по-разному. Рассмотрим, какие установлены в отношении такого участия правила, которым обязаны следовать розничные фармпредприятия — представляющие собой, возможно, самую массовую категорию субъектов, которые осуществляют операции с медикаментами.
Принципы функционирования системы мониторинга фармпрепаратов
На первом звене всей цепочки проставляется QR-код, который впоследствии будет основным средством проверки подлинности. Это делается на заводе. При передаче дистрибьютору информация обновляется, также – при переходе на место продажи или в больницу. Отслеживается весь путь, вплоть до реализации покупателю или пациенту. Тогда код выходит из оборота.
С момента производства контролирующие органы могут видеть, где находится препарат и сколько осталось до конца срока годности.
Прием товара в аптеке и маркировка
Отгрузка лекарственных средств может проходить по прямому или обратному акцепту. Прямая передача подразумевает двойную проверку, защищает от пересортицы. Поставщик отправляет в систему сообщение о сборе заказа с полным перечнем. Получатель после сверки фактического наличия с данными электронного документа подтверждает прием в системе. В случае несовпадения отдельных позиций оформляет возврат.
В систему маркировки лекарств при обратном акцепте данные заносятся один раз. Поставщик отправляет груз по ТТН, не отправляя данные в систему. Получатель, в данном случае аптека, принимает товар и вносит данные в МДЛП. К отправителю приходит электронное уведомление о получении товара. Он должен согласится со списком, если данные совпадают, либо опровергнуть его при наличии расхождений.
Программа маркировки лекарств позволяет оперативно принять партию любого объема. Со специализированным ПО вы сможете выполнить прием, возврат, отказ от приема и выбытие ЛС, а также узнать статус маркировочного кода препарата.
Розничная продажа лекарств в аптеках
Выбытие лекарственных средств осуществляется несколькими способами: через онлайн-кассу, регистратор выбытия, программу учета, способную взаимодействовать с ИС МДЛП, и через личный кабинет Честного ЗНАКа. Аптекам, работающим только со льготными препаратами без использования онлайн-касс, оператор предоставляет регистратор выбытия.
Помимо реализации, существует еще несколько причин выбытия лекарств из оборота:
Закажите кассу и начинайте продавать
С Модулькассой это будет быстрее и удобнее
Оставляя заявку, вы соглашаетесь на обработку персональной информации ООО «Аванпост»
Спасибо! Скоро наш оператор свяжется с вами для подтверждения заказа.
Эти операции проводятся через личный кабинет или программу учета, например, «Астрал. Маркировка», «1С:Розница. Аптека». Работа с ИС маркировки лекарств в больничной аптеке аналогичная деятельности городских аптечных пунктов. Однако они используют специализированные программы учета, например, «1С:Медицина. Больничная аптека». Это обусловлено более широким список выполняемых функций. Больничные аптеки могут работать с населением либо предоставлять препараты исключительно в медицинские учреждения. Они могут также заниматься производством отдельных препаратов, выступая в этом случае в качестве производителя.
Как производителю работать с маркировкой
Производитель обязан наносить на каждую потребительскую упаковку уникальный двумерный код Data Matrix. Этот код содержит информацию о препарате:
Помимо этого, при необходимости он может содержать наименование препарата и производителя, срок годности лекарства, инструкцию по использованию и другую информацию.
Как отсканировать код
Если лекарство не настоящее, программа тут же сообщит об этом. Считыватель наводится на штрихкод. Считывается он автоматически, а затем – выводит новую информацию. Работать подобный механизм может как на смартфонах, так и в зале аптеки.
Текущие недоработки системы
Дублирование наименований лекарств
Работа в ИС «Маркировка» построена так, что одна из сторон соглашается с тем, какая информация ей передается. И возможности ее редактирования нет. При этом одинаковые лекарственные препараты в документах разных контрагентов могут называться по-разному. Это приводит к дублям в системе учета, от которых не избавиться. Когда появится единый реестр с названиями препаратов, неизвестно.
Передача информации о выводе лекарств из оборота раньше их использования
Маркировка только вторичной упаковки привела к тому, что при отгрузке ЛП для медицинского применения в систему мониторинга выгружается информация только о ней. То есть препараты выводятся из оборота раньше, чем могут быть израсходованы. Поэтому возникают ситуации, когда по законным причинам лекарства могут быть не израсходованы, но выведены из оборота. Механизм обратного ввода в оборот существует. Но в случае с медорганизациями пока не понятно, что является достаточным основанием для этого.
Брак при нанесении штрихкодов с криптозащитой
Есть нерешенные проблемы и на этапе упаковки препаратов. Фармпроизводители утверждают, что при нанесении штрихкодов с криптозащитой, процент брака доходит до 89%. Связано это с длиной электронной подписи. По действующим нормативным актам она должна состоять из 88 знаков. Производители просят ее сократить до 20. Вопрос пока не решен, однако переносить сроки внедрения обязательной маркировки не планируется.
Штрафы за отсутствие маркировки
За нарушение правил реализации товаров, подлежащих обязательной маркировке, российским законодательством предусмотрена ответственность
Подключиться к Честному Знаку
Особенности регистрации
Чтобы пройти процедуру регистрации в системе маркировки лекарственных препаратов, нужно сначала проверить наличие требуемой версии операционной системы: Windows (7 и выше) и Mac OS (10.8 и выше). Можно использовать такие виды браузеров: Mozilla Firefox, Opera, Internet Explorer 11, Safari Google Chrome.
Требуется загрузка криптографического плагина и драйверов для электронно-цифровой подписи. Инструкция доступна на официальных порталах производителей или в центр, где проводилось оформление цифровой подписи.
Последовательность действий при регистрации:
Нужно авторизоваться повторно и можно приступать к работе. На этом процесс регистрации заканчивается.
Маркировка лекарственных средств и сроки ее проведения
Внедрение маркировки медикаментов проходило поэтапно:
Штраф или лишение свободы?
В случае несоблюдения требований об обязательной маркировке продукции аптеки и медицинские учреждения понесут несут как административную, так и уголовную ответственность:
· административный штраф до 300 тыс. руб. с изъятием непромаркированной продукции
· уголовная ответственность наступает в случаях, когда стоимость непромаркированной продукции превышает крупный или особо крупный размер (от 1,5 млн руб.) и облагается штрафом в размере до 300 тыс. руб. или лишением свободы до 3 лет со штрафом до 80 тыс. руб.
Задачи системы мониторинга перемещения лекарственных препаратов
Данная система является центральным элементом процесса, раскрывает суть маркировки лекарственных средств. База содержит информацию про производителей, импортеров, изготовителей. Дистрибьютеров, продавцов медикаментов и такие действия с фармацевтической продукцией:
Информационная система мониторинга движения лекарств – это элемент Национальной системы «Честный знак», основная задача которой заключается в том, чтобы защитить потребителей от низкокачественной продукции. При отсутствии специального кода на лекарстве или нарушении норм при его нанесении, товар не может добавляться в систему.
Подробно о маркировке лекарств
Маркировкой медикаментов добиваются выполнения задач:
Маркировка дает возможность потребителю самостоятельно проверять подлинность купленных лекарств. Все, что требуется для этого: установить на смартфон (планшет) программу «Честный ЗНАК» и в ней просканировать штрих-код на упаковке-этикетке товара. Приложение автоматически покажет информацию – где, когда произвели лекарство, через какие фирмы было закуплено, срок хранения и т.д.
Штрафные санкции
Если лекарственные препараты, подлежащие обязательной маркировке, выпускаются и продаются без соответствующего кода, с 01.07.2020 года накладываются штрафы, размеры которых следующие:
Возможно участие в обороте препаратов без маркировочного кода, если они были выпущены до 01.07.2019 года, до момента окончания срока годности.
Центр развития перспективных технологий (ЦРПТ) является оператором системы мониторинга. За то, что он предоставляет коды маркировки, взимается плата, составляющая 50 коп (без НДС) за одну марку. Бесплатно получить код можно на медикаменты, которые относятся к категории жизненно необходимых, и отпускаются производителем по цене максимум 20 руб.
Зная лекарства, подлежащие обязательной маркировке, организации, которые занимаются сбытом, смогут избежать штрафов. Для потребителей это возможность защититься от фальсификата и некачественной продукции, сохранить свое здоровье.
Какие организации являются пользователями системы маркировки лекарств?
Все юридические лица и индивидуальные предприниматели, которые задействованы в обороте медикаментов и других товаров фармацевтической промышленности, обязаны выполнять ряд действий для учета продукции в системе мониторинга лекарственных препаратов и их беспрепятственного перехода к другому следующему участнику.
Каждая организация в процессе обращения препаратов имеет свои обязанности:
Какие лекарства подлежат маркировке?
Их перечень можно узнать на сайте государственного реестра медикаментов. Здесь нужно ввести конкретное название препарата. Если в реестре он отсутствует, маркировка не требуется.
Все виды медикаментозных препаратов должны маркироваться, начиная с 01.07.2020 года, что предусмотрено ст. 67 Федерального закона от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств».
Некоторые лекарственные средства подлежащие маркировке должны обязательно проходить данную процедуру еще с 2019 года. В их числе препараты, которые относятся к категории высокозатратных нозологий и используются в лечении следующих состояний:
Обязательная маркировка лекарственных средств и ее особенности для лечения перечисленных состояний утверждается постановлением № 1557 от 14 декабря 2018 года, утвержденным Правительством РФ.
Основные моменты содержит Положение о системе мониторинга движения лекарств, которые применяются в медицине (постановление от 14 декабря 2018 года №1557, которое утвердило Правительство России).
Сроки перемен
Планируется маркировку вводить в 2020 поквартально:
I квартал – маркировка наносится на те препараты, которые уже маркировались экспериментальном режиме в 2017–2019 гг.
II квартал – маркировка наносится на все жизненно важные препараты, цена которых не превышает 500 руб.
III квартал – маркировка наносится на все жизненно важные препараты, цена которых не превышает 100 руб.
IV квартал – маркируются все остальные препараты.







